エリキュース錠5mg
添付文書番号
企業コード
作成又は改訂年月
| ** | 2024年 7月改訂 ( 第6版 ) |
| * | 2023年 11月改訂 ( 第5版 ) |
日本標準商品分類番号
薬効分類名
承認等
エリキュース錠5mg
販売名コード
YJコード
販売名英語表記
販売名ひらがな
承認番号等
承認番号
販売開始年月
貯法・有効期間
貯法
有効期間
規制区分
処方箋医薬品 注2)
注2) 注意―医師等の処方箋により使用すること一般的名称
1. 警告
- <効能共通>
- 1.1 本剤の投与により出血が発現し、重篤な出血の場合には、死亡に至るおそれがある。本剤の使用にあたっては、出血の危険性を考慮し、本剤投与の適否を慎重に判断すること。本剤による出血リスクを正確に評価できる指標は確立されていないため、本剤投与中は、血液凝固に関する検査値のみならず、出血や貧血等の徴候を十分に観察すること。これらの徴候が認められた場合には、直ちに適切な処置を行うこと。[2.2 参照][2.3 参照][7.1 参照][7.2 参照][8.1 参照][8.2 参照][8.11 参照][9.1.1 参照][9.1.2 参照][9.2.2 参照][9.2.4 参照][13.1 参照][13.2 参照]
- <静脈血栓塞栓症(深部静脈血栓症及び肺血栓塞栓症)の治療及び再発抑制>
2. 禁忌(次の患者には投与しないこと)
- <効能共通>
- <非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制>
- 2.4 腎不全(クレアチニンクリアランス(CLcr)15mL/min未満)の患者[9.2.1 参照]
- <静脈血栓塞栓症(深部静脈血栓症及び肺血栓塞栓症)の治療及び再発抑制>
- 2.5 重度の腎障害(CLcr30mL/min未満)の患者[9.2.3 参照]
3. 組成・性状
5. 効能又は効果に関連する注意
- <静脈血栓塞栓症(深部静脈血栓症及び肺血栓塞栓症)の治療及び再発抑制>
- 5.1 ショックや低血圧が遷延するような血行動態が不安定な肺血栓塞栓症患者又は血栓溶解剤の使用や肺塞栓摘出術が必要な肺血栓塞栓症患者における有効性及び安全性は確立していないため、これらの患者に対してヘパリンの代替療法として本剤を投与しないこと。
- 5.2 下大静脈フィルターが留置された患者における本剤の使用経験が少ないため、これらの患者に投与する場合には、リスクとベネフィットを十分考慮すること。[17.1.3 参照]
6. 用法及び用量
7. 用法及び用量に関連する注意
- <非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制>
- 7.1 次の基準の2つ以上に該当する患者は、出血のリスクが高く、本剤の血中濃度が上昇するおそれがあるため、1回2.5mg 1日2回経口投与する。[1.1 参照][17.1.1 参照]
- 80歳以上[9.8 参照]
- 体重60kg以下
- 血清クレアチニン1.5mg/dL以上
- 7.1 次の基準の2つ以上に該当する患者は、出血のリスクが高く、本剤の血中濃度が上昇するおそれがあるため、1回2.5mg 1日2回経口投与する。[1.1 参照][17.1.1 参照]
- <静脈血栓塞栓症(深部静脈血栓症及び肺血栓塞栓症)の治療及び再発抑制>
- 7.2 特に静脈血栓塞栓症発症後の初期7日間の1回10mg 1日2回投与中は、出血のリスクに十分注意すること。[1.1 参照]
8. 重要な基本的注意
- <効能共通>
- 8.1 凝固能検査(プロトロンビン時間(PT)、国際標準比(INR)、活性化部分トロンボプラスチン時間(aPTT)等)は、本剤の抗凝固能をモニタリングする指標とはならないため、本剤投与中は出血や貧血等の徴候を十分に観察すること。また、必要に応じて、血算値(ヘモグロビン値)、便潜血等の検査を実施し、急激なヘモグロビン値や血圧の低下等の出血徴候を確認すること。臨床的に問題となる出血や貧血の徴候が認められた場合には、本剤の投与を中止し、出血の原因を確認すること。また、症状に応じて、適切な処置を行うこと。[1.1 参照][2.2 参照][11.1.1 参照]
- 8.2 患者には、鼻出血、皮下出血、歯肉出血、血尿、喀血、吐血及び血便等、異常な出血の徴候が認められた場合、医師に連絡するよう指導すること。[1.1 参照][2.2 参照]
- 8.3 抗血小板薬2剤との併用時には、出血リスクが特に増大するおそれがあるため、本剤との併用についてはさらに慎重に検討し、治療上の有益性が危険性を上回ると判断された場合のみ、これらの薬剤と併用すること。[10.2 参照][15.1.1 参照]
- 8.4 ビタミンK拮抗剤(ワルファリン)から本剤へ切り替える際には、ビタミンK拮抗剤の投与を中止し、PT-INRが非弁膜症性心房細動患者では2.0未満、静脈血栓塞栓症患者では治療域の下限未満となってから本剤の投与を開始すること。
- 8.5 本剤からビタミンK拮抗剤(ワルファリン)に切り替える際には、PT-INRが治療域の下限を超えるまでは、本剤とワルファリンを併用すること。
- 8.6 他の抗凝固剤(注射剤)から本剤に切り替える場合、次回に投与を予定していた時間まで間隔をあけて、本剤の投与を開始すること。ただし、抗凝固剤(ヘパリン等)の持続静注から切り替える場合は、持続静注中止と同時に本剤の投与を開始すること。
- 8.7 本剤から他の抗凝固剤(注射剤)へ切り替える場合は、次回に投与を予定していた時間まで間隔をあけて、切り替える薬剤の投与を開始すること。
- 8.8 待機的手術又は侵襲的手技を実施する患者では、患者の出血リスクと血栓リスクに応じて、本剤の投与を一時中止すること。出血に関して低リスク又は出血が限定的でコントロールが可能な手術・侵襲的手技を実施する場合は、前回投与から少なくとも24時間以上の間隔をあけることが望ましい。また、出血に関して中~高リスク又は臨床的に重要な出血を起こすおそれのある手術・侵襲的手技を実施する場合は、前回投与から少なくとも48時間以上の間隔をあけること。なお、必要に応じて代替療法(ヘパリン等)の使用を考慮すること。緊急を要する手術又は侵襲的手技を実施する患者では、緊急性と出血リスクが増大していることを十分に比較考慮すること。
- 8.9 待機的手術、侵襲的手技等による抗凝固療法(本剤を含む)の一時的な中止は、塞栓症のリスクを増大させる。手術後は、患者の臨床状態に問題がなく出血がないことを確認してから、可及的速やかに再開すること。
- 8.10 患者の判断で本剤の服用を中止することのないよう十分な服薬指導をすること。本剤を服用し忘れた場合には、気づいたときにすぐに1回量を服用し、その後通常どおり1日2回服用するよう指導すること。服用し忘れた場合でも一度に2回量を服用しないよう指導すること。
- 8.11 本剤投与中の患者で生命を脅かす出血又は止血困難な出血の発現時に本剤の抗凝固作用の中和を必要とする場合には、中和剤であるアンデキサネット アルファ(遺伝子組換え)の電子添文を必ず参照し、禁忌、用法及び用量に関連する注意、重要な基本的注意、特定の背景を有する患者に関する注意、副作用等の使用上の注意の記載を確認すること 。[1.1 参照]
- <静脈血栓塞栓症(深部静脈血栓症及び肺血栓塞栓症)の治療及び再発抑制>
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.5 妊婦
9.6 授乳婦
授乳しないことが望ましい。動物実験(ラット)で乳汁中への移行が認められている5) 。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に腎機能が低下し本剤の血中濃度が上昇するおそれがある。非弁膜症性心房細動患者に対して本剤を投与する場合、特に80歳以上の患者に対しては、腎機能低下(血清クレアチニン1.5mg/dL以上)及び体重(60kg以下)に応じて本剤を減量すること。[7.1 参照][16.6.3 参照]
**,*10. 相互作用
10.2 併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
|
本剤の血中濃度が上昇するおそれがあるため、本剤の減量(1回10mgの場合は5mg、1回5mgの場合は2.5mg)を考慮すること、あるいは、治療上の有益性と危険性を十分に考慮し、本剤との併用が適切と考えられない患者には併用しないこと。 |
これらの薬剤がCYP3A4及びP-糖蛋白を同時に強力に阻害するため、本剤の代謝及び排出が阻害されると考えられる。 |
|
|
本剤の血中濃度が上昇するおそれがある。 |
これらの薬剤のCYP3A4及び/又はP-糖蛋白の阻害作用により、本剤の代謝及び排出が阻害されると考えられる。 |
|
|
本剤の血中濃度が減少するおそれがある。 |
これらの薬剤又はセイヨウオトギリソウがCYP3A4及びP-糖蛋白を同時に強力に誘導するため、本剤の代謝及び排出が促進されると考えられる。 |
|
|
抗血小板薬との併用は、出血リスクが増大することに注意すること。特に抗血小板薬2剤との併用は、治療上の有益性が危険性を上回ると判断された場合のみ、併用すること。 |
本剤は抗凝固作用を有するため、これら薬剤と併用すると出血を助長するおそれがある。 |
|
|
これらの薬剤との併用により、出血の危険性が増大する可能性がある。出血の徴候を十分に観察すること。 |
本剤は抗凝固作用を有するため、これら薬剤と併用すると出血を助長するおそれがある。 |
|
|
** レカネマブ(遺伝子組換え) |
相手薬投与中に脳出血を発現した場合、本剤が出血を助長するおそれがある。併用時には脳出血の副作用に注意すること。 |
相手薬の副作用として脳出血の報告がある。併用により血液凝固阻止剤である本剤が出血を助長する可能性がある。 |
11. 副作用
11.1 重大な副作用
- 11.1.1 出血
頭蓋内出血(頻度不明)、消化管出血(0.6%)、眼内出血(0.3%)等の出血があらわれることがある。[8.1 参照]
- 11.1.2 間質性肺疾患(頻度不明)
咳嗽、血痰、息切れ、呼吸困難、発熱、肺音の異常等が認められた場合には、速やかに胸部X線、胸部CT、血清マーカー等の検査を実施すること。間質性肺疾患が疑われた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
- 11.1.3 肝機能障害(頻度不明)
AST、ALTの上昇等を伴う肝機能障害があらわれることがある。
- *11.1.4 *急性腎障害(頻度不明)
経口抗凝固薬の投与後に急性腎障害があらわれることがある。経口抗凝固薬投与後の急性腎障害の中には、血尿を認めるもの、腎生検により尿細管内に赤血球円柱を多数認めるものが報告されている6) ,7) 。
11.2 その他の副作用
|
1%以上 |
1%未満 |
頻度不明 |
|
|---|---|---|---|
|
免疫系障害 |
過敏症(皮疹等の薬物過敏症、アレルギー性浮腫等のアナフィラキシー反応等) |
||
|
神経系障害 |
味覚異常、くも膜下出血、三叉神経痛 |
脳出血、頭蓋内又は脊髄内出血(硬膜下血腫及び脊髄血腫等) |
|
|
眼障害 |
眼出血 |
眼充血 |
|
|
血管障害 |
血腫 |
腹腔内出血 |
|
|
呼吸器、胸郭及び縦隔障害 |
鼻出血 |
喀血、咳嗽 |
気道出血(肺胞出血、喉頭出血、及び咽頭出血等) |
|
胃腸障害 |
歯肉出血、胃腸出血、消化不良、便潜血陽性 |
口腔内出血、便秘、腹部不快感、上腹部痛、血便排泄、下痢、逆流性食道炎、悪心 |
直腸出血、痔出血、後腹膜出血、吐血、マロリー・ワイス症候群、出血性消化性潰瘍 |
|
肝胆道系障害 |
血中ビリルビン増加、γ-GTP増加、肝機能異常 |
||
|
腎及び尿路障害 |
血尿、尿中血陽性 |
尿中蛋白陽性 |
|
|
生殖系及び乳房障害 |
前立腺炎、膣出血、不規則月経 |
不正出血、尿生殖器出血、月経過多 |
|
|
傷害、中毒及び処置合併症 |
挫傷 |
処置後出血 |
外傷性出血、切開部位出血、血管偽動脈瘤 |
|
皮膚及び皮下組織障害 |
円形脱毛症、そう痒症、紫斑、膿疱性乾癬、顔面腫脹、水疱、点状出血、皮膚びらん |
斑状出血、出血性皮膚潰瘍 |
|
|
その他 |
初期不眠症、疲労、血小板減少症、血中ブドウ糖変動、高尿酸血症、血中ブドウ糖増加、血中CK増加、末梢性浮腫、動悸 |
適用部位出血、注射部位血腫、血管穿刺部位血腫 |
13. 過量投与
- 13.1 症状
本剤の過量投与により、出血リスクが増大する。[1.1 参照]
- 13.2 処置
出血の徴候が認められた場合には、適切な処置を行うこと。また、活性炭による処置を考慮すること。
外国人健康成人において、本剤20mgを経口投与後2及び6時間に活性炭を経口投与したとき、アピキサバンのCmaxは変化しなかったが、AUCは約50%及び27%低下し、消失半減期は活性炭非投与時の13.4時間から5.3及び4.9時間に短縮した8) 。
血液透析による除去は有効ではない。
出血した場合には、症状に応じて外科的止血や新鮮凍結血漿の輸注等も考慮すること。[1.1 参照][16.6.1 参照]
14. 適用上の注意
15. その他の注意
15.1 臨床使用に基づく情報
- 15.1.1 日本人を含む急性冠症候群の患者(承認外効能・効果)を対象とした国際共同臨床試験において、本剤5mg 1日2回群とプラセボ群の比較が行われたが、本剤群で臨床的に重要な出血の増加が認められたこと等から、試験は早期に中止となった。この試験ではほとんどの患者でアスピリン及びチエノピリジン系抗血小板薬の2剤との併用が行われていた9) 。[8.3 参照][10.2 参照]
- 15.1.2 海外において実施された3抗体(ループスアンチコアグラント、抗カルジオリピン抗体、抗β2グリコプロテインI抗体)のいずれもが陽性で、血栓症の既往がある抗リン脂質抗体症候群患者を対象とした直接作用型経口抗凝固薬(リバーロキサバン)とワルファリンの非盲検無作為化試験において、血栓塞栓性イベントの再発が、ワルファリン群61例では認められなかったのに対し、リバーロキサバン群では59例中7例に認められたとの報告がある10) 。
16. 薬物動態
16.1 血中濃度
- 16.1.1 単回投与
健康成人に、アピキサバン2.5及び10mg(各投与量12例)を空腹時に単回経口投与した時、投与後3~3.5時間で最高血漿中濃度に達し、消失半減期は6~8時間であった11) 。
投与量
(mg)Cmax
(ng/mL)AUC0-∞
(ng・h/mL)Tmax
(h)T1/2
(h)2.5
52.5
(16)466
(17)※3.50
(1.5, 6.0)6.12
(1.21)※10
175.7
(22)1628
(18)3.00
(1.0, 6.0)8.11
(4.18)各投与量12例、Cmax及びAUC0-∞は幾何平均値(変動係数%)、Tmaxは中央値(範囲)、※N=10
T1/2は算術平均値(標準偏差)
Cmax:最高血漿中濃度
AUC0-∞:無限大時間までの血漿中濃度-時間曲線下面積
Tmax:最高血漿中濃度到達時間
T1/2:消失半減期 - 16.1.2 反復投与
健康成人6例に、アピキサバン1回2.5、5及び10mg 1日2回反復投与したとき、投与3日目に定常状態に到達し、累積係数は1.7~2.0であった12) 。
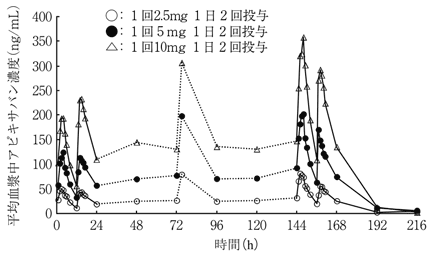
16.2 吸収
16.3 分布
16.4 代謝
16.5 排泄
16.6 特定の背景を有する患者
- 16.6.1 腎機能障害者
軽度(CLcr:51~80mL/min、10例)、中等度(CLcr:30~50mL/min、7例)及び重度(CLcr:15~29mL/min、7例)の腎機能障害を有する被験者への投与において、アピキサバンのAUCは、正常なCLcrの被験者と比較して、それぞれ16、29及び44%増加した(回帰モデルによる推定値)22) (外国人データ)。
末期腎疾患(ESRD)を有する被験者に血液透析直後にアピキサバン5mgを単回投与したとき、AUCは腎機能が正常な被験者と比較して36%増加した。ESRDを有する被験者にアピキサバン5mgを単回投与し2時間後に血液透析を行ったとき、血液透析直後にアピキサバンを投与した場合と比較してAUCは14%減少し、アピキサバンの透析クリアランスは18mL/minであった23) (外国人データ)。[13.2 参照] - 16.6.2 肝機能障害者
軽度(Child-Pugh A)及び中等度(Child-Pugh B)の肝機能障害被験者(各8例)及び健康成人(16例)にアピキサバン5mgを単回経口投与したとき、肝障害被験者及び健康成人の薬物動態は類似していた24) (外国人データ)。
- 16.6.3 高齢者及び女性
21~40歳の男女40例及び65~79歳の男女39例にアピキサバン20mg注)を単回投与したとき、Cmaxに年齢の影響は認められなかったが、AUCは高齢者でやや高い値(32%)を示した。[9.8 参照]
また、女性被験者のCmax及びAUCは男性被験者と比較して、約18%及び約15%高かった25) (外国人データ)。 - 16.6.4 低体重(体重50kg以下)及び過体重(体重120kg以上)
体重50kg以下(18例)、65~85kg(18例)、及び120kg以上(19例)の被験者55例にアピキサバン10mgを単回投与したときのCmax及びAUCは、65~85kg群と比較して50kg以下群では約30%及び約20%高く、120kg以上群では約30%及び約20%低かった26) (外国人データ)。
16.7 薬物相互作用
- 16.7.1 ケトコナゾール
健康成人18例を対象に、CYP3A4及びP-糖蛋白の強力な阻害剤であるケトコナゾール(1回400mg 1日1回経口投与)とアピキサバン(10mg単回投与)を併用投与したとき、アピキサバンのAUC及びCmaxの平均値は、アピキサバン単独投与と比較して、それぞれ2及び1.6倍増加した27) (外国人データ)。[10.2 参照]
- 16.7.2 ジルチアゼム
健康成人18例を対象に、ジルチアゼム(1回360mg 1日1回投与)とアピキサバン(10mg単回投与)を併用投与したとき、アピキサバンのAUC及びCmaxの平均値は、アピキサバン単独投与と比較して、それぞれ1.4及び1.3倍増加した27) (外国人データ)。[10.2 参照]
- 16.7.3 ナプロキセン
健康成人21例を対象に、ナプロキセン(500mg単回投与)とアピキサバン(10mg単回投与)を併用投与したとき、アピキサバンのAUC及びCmaxの平均値は、アピキサバン単独投与と比較して、それぞれ1.5及び1.6倍増加した28) (外国人データ)。[10.2 参照]
- 16.7.4 リファンピシン
健康成人20例を対象に、リファンピシン(1回600mg 1日1回投与)とアピキサバン(10mg単回投与)を併用投与したとき、アピキサバンのAUC及びCmaxの平均値は、アピキサバン単独投与と比較して、それぞれ54%及び42%減少した29) (外国人データ)。[10.2 参照]
- 16.7.5 エノキサパリン
健康成人20例を対象に、エノキサパリン(40mg単回投与)とアピキサバン(5mg単回投与)を併用投与したとき、Xa因子の阻害は相加的であった30) (外国人データ)。[10.2 参照]
16.8 その他
- 16.8.1 QT間隔に対する影響
健康成人40例を対象に、アピキサバン1回50mg注)1日1回3日間投与したとき、プラセボで補正したQTc間隔は延長しなかった31) (外国人データ)。
注:本剤の承認用量は、非弁膜症性心房細動には1回2.5mg又は5mgを1日2回、静脈血栓塞栓症には1回10mgを1日2回7日間投与後1回5mgを1日2回投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
- <非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制>
- 17.1.1 国際共同第III相試験
非弁膜症性心房細動患者18,201例(日本人336例を含む)を対象に、アピキサバン5mg 1日2回(以下、5mg BID)(ただし、血清クレアチニン1.5mg/dL以上、体重60kg以下、年齢80歳以上の3項目のうち2項目を満たす患者は2.5mg 1日2回(以下、2.5mg BID))、又は対照薬としてワルファリン(PT-INR 2.0~3.0となるように適宜調節)を投与した二重盲検群間比較試験(ARISTOTLE試験)を実施し、主要有効性評価項目である脳卒中(虚血性、出血性、及び特定不能)又は全身性塞栓症の初回発現までの期間を指標にアピキサバンのワルファリンに対する非劣性を検証した(非劣性マージン=1.38及び有意水準0.025(片側))。[7.1 参照]
Intention-to-treat集団を対象に解析した結果、発現率はアピキサバン群1.27%/年に対しワルファリン群1.60%/年であり、有効性に関してワルファリンに対し21%の抑制(ハザード比(HR)0.79、95%信頼区間(CI)0.66~0.95)が確認され、本剤の非劣性が確認された。また、全死亡の発現率は、アピキサバン群で3.52%/年、ワルファリン群で3.94%/年であった(HR 0.89、95%CI 0.80~1.00)。
一方、出血性イベント(ISTH基準の大出血)の発現率は、アピキサバン群2.13%/年に対してワルファリン群3.09%/年であり、アピキサバンはワルファリンに比べ減少した(HR 0.69、95%CI 0.60~0.80)。また、アピキサバンとアスピリンの併用により、出血リスクは1.8%/年から3.4%/年へ増大、ワルファリンとアスピリンの併用により、2.7%/年から4.6%/年へ増大することが示された32) ,33) 。
アピキサバン群における副作用発現頻度は、27.8%(2,524/9,088例)であった。主な副作用は、鼻出血5.0%(456/9,088例)、血尿2.6%(234/9,088例)、挫傷1.7%(151/9,088例)、血腫1.4%(129/9,088例)及び貧血1.1%(103/9,088例)であった。ARISTOTLE試験における主要有効性/安全性評価項目結果(平均投与期間:アピキサバン群1.71年、ワルファリン群1.68年) 主要有効性/
安全性イベントイベント発現例数/患者数
(年間イベント発現率)ハザード比
(95%信頼区間)アピキサバン
ワルファリン
脳卒中/全身性塞栓症
複合評価項目212/9120
(1.27%/年)265/9081
(1.60%/年)0.79
(0.66, 0.95)全死亡
603/9120
(3.52%/年)669/9081
(3.94%/年)0.89
(0.80, 1.00)ISTH基準の大出血
327/9088
(2.13%/年)462/9052
(3.09%/年)0.69
(0.60, 0.80)10/9088
(0.06%/年)37/9052
(0.24%/年)-
52/9088
(0.33%/年)122/9052
(0.80%/年)-
118/9088
(0.76%/年)130/9052
(0.86%/年)-
日本人集団においては、有効性イベント(脳卒中/全身性塞栓症)の発現率は、アピキサバン群3/161例(0.87%/年)、ワルファリン群6/175例(1.67%/年)であった。また、安全性に関して、出血性イベント(ISTH基準の大出血)の発現率は、アピキサバン群4/160例(1.26%/年)、ワルファリン群18/175例(5.99%/年)であり、日本人集団においてもアピキサバン群はワルファリン群に比べ、大出血の年間イベント発現率は低かった。また、これらの結果は、全体の結果と比較して同様の傾向がみられた。
日本人集団のアピキサバン群における副作用発現頻度は、28.1%(45/160例)であった。主な副作用は、鼻出血6.9%(11/160例)、皮下出血5.0%(8/160例)、結膜出血2.5%(4/160例)、挫傷、皮下血腫、便潜血及び血尿 各1.9%(3/160例)であった。ARISTOTLE試験の日本人部分集団における主要有効性/安全性評価項目結果(平均投与期間:アピキサバン群約2.00年、ワルファリン群約1.75年) 主要有効性/
安全性イベントイベント発現例数/患者数
(年間イベント発現率)アピキサバン
ワルファリン
脳卒中/全身性塞栓症
複合評価項目3/161
(0.87%/年)6/175
(1.67%/年)全死亡
6/161
(1.74%/年)11/175
(3.02%/年)ISTH基準の大出血
4/160
(1.26%/年)18/175
(5.99%/年)0/160
(0%/年)2/175
(0.65%/年)0/160
(0%/年)6/175
(1.97%/年)2/160
(0.63%/年)6/175
(1.97%/年) - 17.1.2 国内第II相試験
非弁膜症性心房細動患者222例を対象としてアピキサバン(2.5mg BID、あるいは5mg BID)についてワルファリン(PT-INR 2.0~3.0となるように適宜調節)を対照薬として12週間投与で行われた部分盲検比較試験(アピキサバン2用量群は二重盲検、ワルファリン群は非盲検)(ARISTOTLE-J試験)で、安全性主要評価項目である大出血、臨床的に重要な非大出血(CRNM)の複合評価項目の発現割合を解析したところ、アピキサバン2.5mg BID群1/72例(1.4%)、アピキサバン5mg BID群1/71例(1.4%)で、ワルファリン群4/75例(5.3%)と比較して本剤で低かった。なお、全ての有害事象の発現割合は各群間に差は認められなかった。また、有効性に関して、脳卒中は、ワルファリン群で3/74例(4.1%)に対してアピキサバン群では発現はなかった。全身性塞栓症、心筋梗塞、全死亡イベントに関しては、アピキサバン群、ワルファリン群ともに発現しなかった34) 。
アピキサバン2用量群における副作用発現頻度は、23.8%(34/143例)であった。主な副作用は、鼻出血3.5%(5/143例)、尿中血陽性2.1%(3/143例)であった。
- 17.1.1 国際共同第III相試験
- <静脈血栓塞栓症患者における治療及び再発抑制>
- 17.1.3 国内第III相試験
急性症候性静脈血栓塞栓症(VTE)患者80例を対象に、アピキサバン10mg BID 7日間投与後、アピキサバン5mg BID、又は対照薬としてヘパリン(UFH)を5日間以上及びワルファリン(PT-INR 1.5~2.5になるように適宜調整)を6ヵ月間投与した注1)非盲検群間比較試験(AMPLIFY-J試験)を実施した。
注1)非経口抗凝固薬による前治療として1日1回投与のフォンダパリヌクスは2回まで、36時間を超えないUFHの持続静注を可とした。治験薬投与開始日までに非経口抗凝固薬が用いられた患者数は、アピキサバン群40例中30例、UFH/ワルファリン群39例中39例であった。
また、VTE治療の補助療法として無作為化時に下大静脈フィルターが留置されていた患者数は、アピキサバン群40例中5例(深部静脈血栓症(DVT)2例、肺血栓塞栓症(PE)3例)、UFH/ワルファリン群40例中6例(DVT4例、PE2例)であった。[5.2 参照]
主要安全性評価項目である大出血/CRNMの複合評価項目の発現割合を解析したところ、アピキサバン群3/40例(7.5%)、UFH/ワルファリン群11/39例(28.2%)で、アピキサバン群で低かった。また、有効性に関して、VTE/VTE関連死の発現割合は、UFH/ワルファリン群1/40例(2.5%)に対し、アピキサバン群での発現はなかった35) 。
アピキサバン群における副作用発現頻度は、32.5%(13/40例)であった。主な副作用は、鼻出血7.5%(3/40例)であった。AMPLIFY-J試験における有効性/安全性評価項目結果 有効性/
安全性イベントイベント発現例数/患者数(発現割合)
アピキサバン
UFH/ワルファリン
VTE/VTE関連死
0/38(0%)
1/40(2.5%)
大出血/CRNM
3/40(7.5%)
11/39(28.2%)
0/40(0%)
2/39(5.1%)
3/40(7.5%)
9/39(23.1%)
小出血
6/40(15.0%)
10/39(25.6%)
全出血
7/40(17.5%)
17/39(43.6%)
- 17.1.4 海外第III相試験
急性症候性静脈血栓塞栓症患者5,395例を対象に、アピキサバン10mg BID 7日間投与後、アピキサバン5mg BID、又は対照薬としてエノキサパリン5日間以上投与及びワルファリン(PT-INR 2.0~3.0になるように適宜調整)を6ヵ月投与した注2)二重盲検群間比較試験(AMPLIFY試験)を実施した。
注2)非経口抗凝固薬による前治療として1日1回投与のフォンダパリヌクス又はエノキサパリンは2回まで、1日2回投与のエノキサパリンは3回まで、36時間を超えないUFHの持続静注を可とした。ランダム化前に非経口抗凝固薬が投与されなかった患者数(前治療なし)は、アピキサバン群2,691例中358例、エノキサパリン/ワルファリン群2,704例中381例であり、非経口抗凝固薬が投与された患者数(前治療あり)は、アピキサバン群2,691例中2,327例、エノキサパリン/ワルファリン群2,704例中2,317例であった。
主要有効性評価項目である症候性VTEの再発又はVTE関連死の発現割合を指標にアピキサバンのエノキサパリン/ワルファリンに対する非劣性が検証された。
一方、出血性イベント(ISTH基準の大出血)の発現割合は、アピキサバン群0.56%に対しエノキサパリン/ワルファリン群1.82%であり、アピキサバン群はエノキサパリン/ワルファリン群に比べ69%減少した(相対リスク(RR)0.31 95%CI 0.17~0.55、p<0.0001)36) 。
アピキサバン群における副作用発現頻度は、19.4%(520/2,676例)であった。主な副作用は、鼻出血2.4%(63/2,676例)、挫傷1.3%(34/2,676例)、月経過多1.2%(33/2,676例)及び血尿1.2%(32/2,676例)であった。AMPLIFY試験における主要有効性/安全性評価項目結果 主要有効性/
安全性イベントイベント発現例数/患者数
(発現割合)相対リスク
(95%信頼区間)アピキサバン
エノキサパリン/ワルファリン
VTE/VTE関連死a)
59/2609
(2.26%)71/2635
(2.69%)0.84
(0.60, 1.18)21/900
(2.33%)23/886
(2.60%)0.90
(0.50, 1.61)38/1698
(2.24%)47/1736
(2.71%)0.83
(0.54, 1.26)ISTH基準の大出血
15/2676
(0.56%)49/2689
(1.82%)0.31
(0.17, 0.55)大出血/CRNM
115/2676
(4.30%)261/2689
(9.71%)0.44
(0.36, 0.55)全出血
402/2676
(15.02%)676/2689
(25.14%)0.59
(0.53, 0.66)a)非劣性の許容限界は相対リスク1.8と設定した。
b)対象イベントが判定されなかった患者については、PE(肺血栓塞栓症)及びDVT(深部静脈血栓症)別の部分集団には含めなかった。
- 17.1.3 国内第III相試験
18. 薬効薬理
18.1 作用機序
アピキサバンは外因性及び内因性血液凝固経路の収束点である第Xa因子を阻害することにより、その下流のプロトロンビンからトロンビンへの変換を抑制し、直接的な抗血液凝固作用及び間接的な抗血小板作用を示す。
18.2 血液凝固系に対する作用
18.3 血小板凝集に対する作用
アピキサバンは直接的なトロンビン阻害作用及び抗血小板作用はないが、トロンビン産生低下作用により組織因子で惹起した血小板凝集を間接的に抑制し、IC50は3.5nmol/Lであった39) 。
19. 有効成分に関する理化学的知見
一般的名称
アピキサバン(Apixaban)
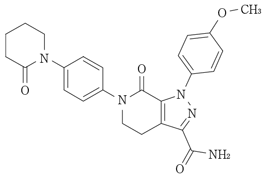
化学名
1-(4-Methoxyphenyl)-7-oxo-6-[4-(2-oxopiperidin-1-yl)phenyl]-4,5,6,7-tetrahydro-1H-pyrazolo[3,4-c]pyridine-3-carboxamide
分子式
C25H25N5O4
分子量
459.50
性状
アピキサバンは白色~微黄色の粉末である。
ジメチルスルホキシドにやや溶けにくく、エタノール(99.5)に極めて溶けにくく、水にほとんど溶けない。
化学構造式
22. 包装
*23. 主要文献
1) 社内資料:マウスを用いた生殖発生毒性試験(2012年12月25日承認、CTD 2.6.6.6)
2) 社内資料:妊娠ラットを用いた組織分布試験(2012年12月25日承認、CTD 2.6.4.4)
3) 社内資料:ラットを用いた生殖発生毒性試験(2012年12月25日承認、CTD 2.6.6.6)
4) 社内資料:ウサギを用いた生殖発生毒性試験(2012年12月25日承認、CTD 2.6.6.6)
5) 社内資料:授乳ラットを用いた組織分布試験(2012年12月25日承認、CTD 2.6.4.4)
6) *Brodsky S, et al.:J Am Soc Nephrol. 2018;29:2787-2793
7) *Zakrocka I, et al.:Adv Clin Exp Med. 2022;31:165-173
8) 社内資料:外国人健康成人被験者における活性炭投与試験(2012年12月25日承認、CTD 2.7.6)
9) Alexander JH, et al.:N Engl J Med. 2011;365(8):699-708
10) Pengo V, et al.:Blood. 2018;132:1365-1371
11) 社内資料:日本人及び外国人健康成人被験者における単回投与試験(2012年12月25日承認、CTD 2.7.6)
12) Yamahira N, et al.:Int J Clin Pharmacol Ther. 2014;52(7):564-573
13) Song Y, et al.:Clin Ther. 2016:38(7):1674-1685
14) 社内資料:アピキサバン静脈内投与を含むリファンピシンとの相互作用(2012年12月25日承認、CTD 2.7.2.2)
15) 社内資料:静脈内投与試験(2012年12月25日承認、CTD 2.7.2.2)
16) 社内資料:マスバランス試験(2012年12月25日承認、CTD 2.7.2.2)
17) 社内資料:ヒトでの蛋白結合率(2012年12月25日承認、CTD 2.6.4.4)
18) 社内資料:ヒトでの代謝(2012年12月25日承認、CTD 2.6.4.5)
19) 社内資料:代謝に関与する酵素の検討(2012年12月25日承認、CTD 2.6.4.5)
20) 社内資料:ヒトでの排泄(2012年12月25日承認、CTD 2.6.4.6)
21) 社内資料:膜透過性(in vitro)(2012年12月25日承認、CTD 2.6.4.3)
22) Chang M, et al.: J Clin Pharmacol. 2016;56(5):637-645
23) Wang X, et al.:J Clin Pharmacol. 2016;56(5):628-636
24) 社内資料:肝機能の影響試験(2012年12月25日承認、CTD2.7.2.2)
25) Frost CE, et al.:Clin Pharmacokinet. 2015;54(6):651-662
26) Upreti VV, et al.:Br J Clin Pharmacol. 2013;76(6):908-916
27) Frost CE, et al.:Br J Clin Pharmacol. 2015;79(5):838-846
28) Frost C, et al.:Br J Clin Pharmacol. 2014;78(4):877-885
29) Vakkalagadda B, et al.:Am J Cardiovasc Drugs. 2016;16:119-127
30) Barrett YC, et al.:Thromb Haemost. 2012;107(5):916-924
31) Frost C, et al.:J Clin Pharmacol. 2015;55(5):549-555
32) 社内資料:非弁膜症性心房細動患者におけるワルファリンを対照とした国際共同第3相試験(ARISTOTLE試験)(2012年12月25日承認、CTD2.7.6)
33) Granger CB, et al.:N Engl J Med. 2011;365(11):981-992
34) Ogawa S, et al.:Circ J. 2011;75(8):1852-1859
35) Nakamura M, et al.:Circ J. 2015;79(6) :1230-1236
36) Agnelli G, et al.:N Engl J Med. 2013;369(9):799-808
37) 社内資料:トロンビン産生に対する作用(2012年12月25日承認、CTD 2.6.2.2)
38) 社内資料:血液凝固に対する作用(2012年12月25日承認、CTD2.6.2.2)
39) 社内資料:血小板凝集に対する作用(2012年12月25日承認、CTD2.6.2.2)
40) 社内資料:血栓及び出血モデルラットにおける作用(2012年12月25日承認、CTD2.6.2.2)
**24. 文献請求先及び問い合わせ先
ブリストル・マイヤーズ スクイブ株式会社 メディカル情報グループ
(住所)東京都千代田区大手町1-2-1
(TEL)0120-093-507
**ファイザー株式会社 Pfizer Connect/メディカル・インフォメーション
(住所)東京都渋谷区代々木3-22-7
(TEL)0120-664-467
26. 製造販売業者等
26.1 製造販売元
ブリストル・マイヤーズ スクイブ株式会社
東京都千代田区大手町1-2-1
26.2 販売元
ファイザー株式会社
東京都渋谷区代々木3-22-7